Elektrokemi, læren om samspillet mellem elektricitet og kemi. Elektrokemiske reaktioner foregår i elektrokemiske celler. Omdannelse af kemisk energi til elektrisk energi sker i et galvanisk element (batteri eller brændselscelle), mens omdannelse af elektrisk energi til kemisk energi sker i en elektrolysator. Andre typer elektrokemiske celler anvendes til gasrensning (elektrokemiske pumper), til elektrokemisk (også kaldet elektrolytisk) rensning af metaller, fx kobber, til udfældning eller opløsning af metaller (elektrokemisk formgivning) og til syntese af kemikalier, fx omdannelse af nitrobenzen til anilin. Korrosion af metaller finder sted i en uønsket type af elektrokemiske celler, som fx opstår, når et metal kommer i kontakt med vand og luftens ilt.
En elektrokemisk celle består af to elektroder, anoden og katoden, adskilt af en elektrolyt. Ved anoden sker en oxidation, fx af hydrogen, H2, til vand, H2O, i en brændselscelleanode
(reaktion 1 mod højre), eller af oxidioner, O2-, til ilt, O2, i en elektrolysatoranode
(reaktion 2 mod højre), hvor e- står for en elektron. Det betyder, at i et galvanisk element er anoden den negative elektrode (pol), og i en elektrolysator er anoden den positive. Tilsvarende sker der en reduktion ved katoden, som er positiv i et galvanisk element (reaktion 2 mod venstre) og negativ i en elektrolysator (reaktion 1 mod venstre).
Når der ikke går elektrisk strøm i en elektrokemisk celle, antager cellespændingen en værdi, som kaldes den elektromotoriske kraft (EMK). Dennes værdi kan beregnes ud fra den såkaldte Nernsts ligning.
En god elektrolyt har en høj ionledningsevne, men ingen elektronledningsevne. Derfor kan de ladningsadskillende reaktioner (reaktion 1 og 2) kun forløbe, når der går en ydre strøm af elektroner i en metallisk ledning. Hvis der trækkes strøm (energi) fra cellen, bliver spændingen lavere end EMK på grund af cellens indre modstand, og elektrolyttens elektriske spændingsgradient får modsat fortegn af cellespændingen. Hvis der tilføres elektrisk energi, ved at cellen påtrykkes en spænding, der er større end EMK, så fungerer cellen som elektrolysator. Strømmen går nu den anden vej, og elektrolyttens elektriske spændingsgradient får samme fortegn som cellespændingen. Ved en elektrokemisk proces er den omsatte stofmængde proportional med den overførte elektriske ladning (Faradays lov, se Faradays love).



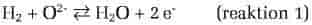



Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.